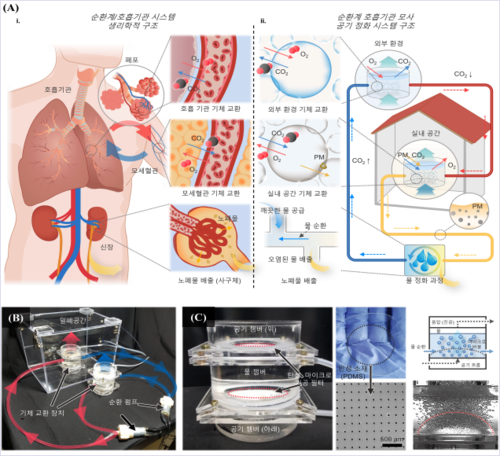
|
많은 비용 들어 확보하기 어려운 Hi-C 데이터 예측해 암 환자 개인별 유전자 발현 조절 이상 확인할 수 있어 - GIST 이현주 교수 - 서울대병원 박성혜 교수 공동연구팀, 암세포의 전장 유전체 정보 활용해 저비용으로 3차원 암 게놈 구조를 높은 정확도로 예측하는 AI 모델 InfoHiC 개발 - 기존 인간 참조 유전체 기반 모델 대비 예측 성능 크게 향상되고 수모세포종 환자 데이터에 적용해 검증… 국제학술지 <Molecular Systems Biology> 표지논문 게재
▲(왼쪽부터) GIST AI대학원 이현주 교수, 서울대학교 의과대학 병리학교실 박성혜 교수, GIST 전기전자컴퓨터공학부 이영훈 박사
암의 발병 기전을 이해하기 위해 암세포의 유전체(게놈)에서 발생하는 돌연변이를 규명하려는 연구가 많이 시도되는 가운데, 최근에는 유전자에서 발생하는 점 돌연변이(point mutation)뿐 아니라 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 주목받고 있다.
광주과학기술원(GIST)은 AI대학원 이현주 교수 연구팀이 서울대병원 박성혜 교수 연구팀과 함께 암세포의 전장 유전체(한 사람의 전체 유전자) 정보를 활용하여 3차원 암(cancer) 게놈*을 예측하는 AI 모델, ‘InfoHiC’를 개발했다고 밝혔다. * 게놈(Genome): 한 생물이 가지는 모든 유전 정보. 일부 바이러스의 RNA를 제외하고 모든 생물은 DNA로 유전 정보를 구성하고 있기 때문에 일반적으로 DNA로 구성된 유전 정보를 지칭함.
암세포에서는 3차원 게놈의 변화가 유전자 발현형의 조절에 중요한 역할을 한다. Hi-C 데이터*를 사용하면 3차원 암 게놈의 neo-TAD* 구조를 확인할 수 있으나, 전장 유전체 데이터*에 비해 상대적으로 분석이 까다롭고 비용도 많이 든다. * 전장유전체 데이터(Whole Genome Sequencing data): 개별 개체의 전체 DNA의 염기 서열을 제공하는 데이터 * Hi-C 데이터: 두 염색질 사이의 공간상의 상대적 거리를 측정하여 DNA의 입체적 3차 구조와 접힘을 분석하기 위한 데이터 * neo-TAD(neo-Topologically Associating Domain): TAD는 세포 속에서 유전체가 3차원적으로 구성되어 작동하는 위상학적으로 연관된 영역을 설명하는 개념임. Neo-TAD에서는 기존 TAD의 변형 때문에 유전자와 조절자 사이의 상호작용이 변경되며, 이로 인해 유전자 발현 패턴이 새롭게 변함.
연구팀이 개발한 InfoHiC는 기존의 방법론과 달리, 사전에 정의된 인간 참조 유전체* 서열이 아닌 암세포의 전장 유전체 데이터를 사용하여 Hi-C 서열 데이터를 예측한다. * 참조 유전체(reference genome): DNA를 재조립할 때 지침이 되는 유전자 지도, 생물의 종을 대표하는 유전체 서열
▲암 3D 게놈 예측 AI 모델인 InfoHiC의 개략도. 해당 모델은 암세포의 전장 유전체 데이터를 입력으로 받아 하플로타입 특이적인 HiC 데이터를 예측한다.
암세포의 염색체에서는 복잡한 구조 변이*가 빈번하게 일어나는데, InfoHiC는 이러한 복잡한 구조 변이에 의한 neo-TAD를 더 높은 정확도로 예측할 수 있다. * 구조 변이(complex structural variation): 개체 염색체의 구조를 변화시키는 삽입(insertion), 삭제(deletion), 중복(duplication), 역위(inversion), 전좌(translocation) 등의 변이
▲개발한 예측 모델 (InfoHiC)의 정확도. 해당 모델은 구조 변이가 없는 영역과 있는 영역에서 모두 기존 모델보다 향상된 성능을 보였다.
연구팀은 이를 통해 비암호화 DNA(non-coding DNA) 영역에서 발생하는 구조적 변이에 의한 neo-TAD 생성 및 인핸서 납치* 현상을 예측함으로써, 비암호화 DNA 영역의 구조 변이가 암의 발생과 진행에 미치는 영향을 종전보다 저비용으로 정확히 밝혀낼 수 있을 뿐만 아니라 암 환자에게서 직접 관찰할 수 있는 기술을 확보하였다. * 인핸서 납치(enhancer-hijacking): 정상 세포에서는 서로 다른 TAD에 속해있던 유전자와 인핸서가 neo-TAD에 의해서 동일한 TAD에 속하게 됨으로써, 유전자와 인핸서의 상호작용에 의해서 유전자가 과발현 되는 현상임.
연구팀이 수모세포종* 환자 A의 전장 유전체 데이터에 InfoHiC를 적용한 결과, 비정상적인 유전자 발현을 유발하는 인핸서 납치 현상을 예측하였고, 이를 통해 유전자 발현 조절 이상을 확인할 수 있었다. * 수모세포종(medulloblastma): 소아의 소뇌 부위에 주로 발생하는 악성 뇌종양으로 뇌간과 연결된 소뇌 중심부에서 발생하며 일부는 소뇌 바깥쪽 소뇌반구라는 부위에서 발생
또한 연구팀은 종양 유전자의 암호화 DNA(coding DNA) 영역에서 돌연변이가 발견되지 않아 치료 타깃 유전자 선정이 힘든 환자 B를 대상으로 InfoHiC를 활용하여 3D 게놈 변이에 따른 유전자 발현 이상을 확인하였는데, 이와 같은 방식으로 InfoHiC가 추후 환자 맞춤형 치료 추천에 기여할 것으로 기대된다.
연구팀은 암세포의 복잡한 구조 변이가 다양한 하플로타입(haplotype) 콘티그(contig)*를 생성하고, neo-TAD가 바로 이러한 하플로타입에 따라 특이적으로 형성된다는 사실에 주목하여 이를 AI 모델에 반영함으로써 3차원 게놈을 예측하였다. * 하플로타입(haplotype): 일반적으로 하나의 염색체(chromosome)에 연결되어 있는 유전적 마커(genetic marker)들의 세트(set)를 의미 * 콘티그(contig): 최근 DNA 시퀀싱 방법이 널리 사용되면서 분자생물학계에서 새롭게 등장한 용어로서 ‘서로 겹치면서 연속되어 있는 DNA 절편들의 집합’을 의미
또한 연구팀은 앞선 연구에서 개발한 바 있는 유전 변이 발굴 및 유전체 복원 알고리즘인 인포지노머(InfoGenomeR)를 활용하여 암 유전체의 하플로타입 콘티그(contig)를 구성하였다.
이로써 유전적 변이가 다른 각 콘티그에 특이적으로 대응하는 Hi-C 데이터의 예측 결과를 결합하여 최종적으로 3차원 게놈을 예측하였다. Hi-C 데이터는 콘티그의 염기서열 및 복제 수 변이를 입력하여 부호화(encoding)한 후, 합성곱 신경망(convolutional neural network, CNN) 구조의 학습을 통해 예측되었다.
기존의 인간 참조 유전체에 기반한 모델과 비교하여 연구팀이 개발한 InfoHiC는 구조 변이가 있는 암세포의 3D 게놈 예측 성능이 크게 향상되었다.
모델 학습에 사용된 데이터와는 별개의 외부 데이터인 유방암 세포주를 활용하여 검증한 결과, 기존 알고리즘의 Pearson’s R 값(실제값과 예측값 사이의 상관관계의 정도를 나타내는 지표)은 0.642이었으나, InfoHiC는 0.715로 11% 향상되었다.
유방암 세포주에서 예측한 neo-TAD 중 20% 이상이 복잡한 구조 변이에서 비롯된 것으로, 이것은 기존의 인간 참조 유전체에 기반한 모델에서는 예측할 수 없다는 결론을 내렸다.
▲개발한 예측 모델(InfoHiC)을 환자 데이터에 적용한 경우의 neoTAD 생성 예측 및 인핸서 납치의 예시. 인핸서 납치에 의해서 PRDM6와 GFI1B, GFI1의 유전자가 과발현되었음을 보여준다.
또한 연구팀이 InfoHiC를 유방암 환자 90명의 전장 유전체 데이터에 적용하여 neo-TAD를 예측한 결과, 여러 환자들에게서 반복적으로 나타나는 neo-TAD 관련 유전자를 발견했는데 인핸서 납치에 의한 이들 유전자의 과발현이 암환자의 생존율과 연관이 높다는 점도 밝혀졌다.
이현주 교수는 “최근에 시퀀싱 데이터 비용의 감소로 암 환자의 전장유전체 데이터는 많이 생산되고 있으나, 이에 반해 3차원 암 게놈을 확인할 수 있는 Hi-C 데이터는 고비용 탓에 확보가 쉽지 않다” 면서 “이번 연구는 Hi-C 데이터 예측을 통해서 비암호화 DNA 영역에서의 구조 변이를 가진 암 환자의 개인 맞춤형 치료에 기여할 수 있을 것”이라고 말했다.
GIST AI대학원 이현주 교수와 서울대학교 의과대학 병리학교실 박성혜 교수의 이번 공동연구는 GIST 전기전자컴퓨터공학부 이영훈 박사가 수행하였으며, 정보통신기획평가원(IITP)의 지원을 받았다. 연구 결과는 생화학 및 분자생물학 분야 상위 10% 국제학술지 《몰레큘러 시스템즈 바이올로지(Molecular Systems Biology)》에 2024년 11월 4일 표지논문으로 게재됐다.
▲《Molecular Systems Biology》에 표지논문으로 게재
<저작권자 ⓒ 대한건설경제 무단전재 및 재배포 금지>
댓글
|
많이 본 기사
|